من منا لم يسأل نفسه لماذا قطرة الماء تبقى معلقة في صنبور الماء لبعض الوقت ? و لماذا تميل السوائل لجعل سطوحها شبه كروية ? , أيضاً لم تكون بعض الحشرات قادرة أن تمشي على سطح الماء? , و كيف بإمكاننا جعل إبرة فولاذية جافة قادرة أن تطفو على سطح الماء إذا وضعت بعناية ?.
إن سبب هذه الظواهر هو الظاهرة السطحية للسوائل التي تعرف باسم التوتر السطحي
تربط بين جزيئات المادة المتجانسة قوى تسمى قوى الجذب الجزيئية ( قوى التماسك ) تعمل على تماسك جزيئات هذه المادة بعضها ببعض , إن قيمة هذه القوى في السوائل تكون أقل مما عليه في الأجسام الصلبة و هذا ما يفسر تغير شكل السائل بتغير الإناء الموجود فيه , بالإضافة على تلك القوى يوجد قوى تؤثر بين جزيئات السائل و جزيئات الأوساط الأخرى التي تلامسها سواء أكانت حالة تلك الأوساط صلبة أو سائلة أو غازية تدعى هذه القوى ب ( قوى التلاصق ) .
الآن و اعتمادا على ما سبق سوف نوضح الفرق بين محصلة قوى الجذب الجزيئية لجزيئات السائل في أوضاعها المختلفة سواء عند السطح أو داخل السائل . الشكل (1)
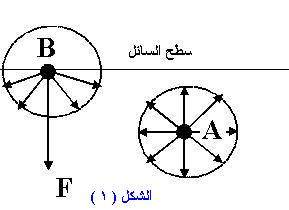
بالنسبة للجزيئات الواقعة في داخل السائل أي على بعد عدة أقطار جزيئية إلى الأسفل من سطحه , فإن كل جزيء مثل ( A ) سوف يتأثر بقوى تماسك مع جزيئات السائل الأخرى من جميع الجهات و بنفس القدر تقريباً مما يعني أن جزيء مثل ( A ) سيكون متأثر بمجموعة متزنة من القوى محصلتها معدومة . أما بالنسبة لجزيئات السائل عند السطح فإن كل جزيء مثل ( B ) سوف يكون متأثر بقوى تماسك مع جزيئات السائل من الجهة السفلى و متأثر بقوى التلاصق مع جزيئات الهواء من الجهة العليا و حيث أن كثافة السوائل أكبر بكثير من كثافة الغازات لذلك فإن محصلة هذه القوى تكون في اتجاه قوى التماسك .
أي أن كل جزيء عند السطح يكون متأثراً بقوى جذب إلى الداخل ( مما يقلل من فرصة شغله موقع سطحي ) تؤدي إلى تقلص سطح السائل ليشغل أصغر مساحة ممكنة له. و هذا يفسر الشكل الشبه الكروي لفطرات السائل و يكون عندئذ سطحها أصغرياً بالنسبة لحجم معين .
و بالتالي عدد الجزيئات الموجودة على السطح أقل من جزيئات السائل , و لذلك فإن البعد المتوسط بين الجزيئات على السطح أكبر قليلاً من البعد المتوسط داخل السائل و هذا يؤدي وسطياً إلى وجود قوى تجاذبية بين جزيئات السطح و هذا يفسر وجود التوتر السطحي.
من ناحية أخرى : يلاحظ أن للجزيئات الموجودة على سطح السائل طاقة كامنة أكبر من الطاقة الكامنة للجزيئات الموجودة وسط السائل وهذا يعود إلى أنه عندما نريد جلب جزيء من السائل إلى السطح يجب كسر عدد من روابطه أي يجب بذل عمل للقيام بذلك وهذا العمل يتحول إلى طاقة كامنة داخل الجزيء. و لكن هذا يخالف الميل الطبيعي للأجسام لتقليل طاقتها , و يتحقق ذلك في السوائل من خلال ميلها الطبيعي لتقليل مساحة سطحها إلى أقل قدر ممكن حيث يبرهن رياضياً أن ذلك يتحقق عندما يكون شكل السطح كروياً .

و الآن لنعرف التوتر السطحي ( γ ) لسائل : القوة المؤثرة في وحدة الطول في سطح بزاوية قائمة على أحد جانبي خط مرسوم في السطح . في الشكل المرسوم جانباً (2) يمثل [ AB ] خطاً مرسوماً طوله ( 1 m ) على سطح سائل يقاس التوتر السطحي (γ ) بوحدة ( N/m ).
من الملاحظات اليومية أننا نلاحظ أن السوائل تكون قطرات و أن الماء مثلا يبلل سطح بعض المواد مثل الزجاج بينما يتكور ولا يبلل أسطح مواد أخرى مثل الشمع. من المعروف أيضا أن الماء يرتفع فى الأنابيب الشعرية و هو ما يسمى بالخاصية الشعرية بينما ينخفض مستوى سطح الزئبق فى الأنبوبة الشعرية التى تغمر فيه.و هناك ملاحظات أخرى مثل إمكانية طفو إبرة من الصلب فوق سطح الماء و مثلها حركة الحشرات فوق سطح الماء و كلها ظواهر تدل على أن السوائل تتصرف كما لو كان سطحها عبارة عن غشاء مرن مشدود .
النظرية الجزيئية و التوتر السطحى
من المعروف أن السائل يتكون من جزيئات تتجاذب مع بعضها. و يتعرض الجزيء فى داخل السائل إلى قوى جذب من الجزيئات التى تحيط به من جميع الجهات . و يتأثر الجزىء بقوى الجذب الناتجة عن الجزيئات الموجودة داخل كرة يكون الجزىء فى مركزها و يمثل نصف قطرها مدى قوة الجذب بين الجزيئات و يساوى 1.6 × 10-6 متر و بالنسبة للجزىء المجود فى باطن السائل تكون القوى المؤثرة عليه متزنة أى تكون محصلتها مساوية صفرا. أما إذا اقترب الجزىء الممثل بمركز الكرة من سطح السائل (شكل ب) فإن القوى المؤثرة على هذا الجزىء تصبح غير متوازنة و السبب فى ذلك هو أن جزء من نصف الكرة العلوى يمتد الآن فوق سطح السائل و بذلك يكون عدد الجزيئات الجاذبة فيه أقل من تلك الموجودة فى النصف الأسفل و تكون هناك محصلة لقوة الجذب إلى داخل السائل.
و كلما زاد اقتراب الجزىء من سطح السائل فإن حالة عدم الإتزان تزداد حتى تبلغ فيمتها العظمى عندما يكون الجزىء على سطح السائل. و لذلك فإن الجزيئات الموجودة على سطح السائل تتعرض إلى قوى جذب كبيرة فى اتجاه داخل السائل. هذه القوى تجعل سطح السائل يميل إلى التقلص ليصغر فى المساحة. ومن ذلك يتضح أنه لزيادة سطح السائل لابد من بذل شغل لكى ندفع ببعض الجزيئات من داخل السائل إلى سطحه و هذا الشغل سيبذل ضد القوى الجاذبة التى تجذب هذه الجزيئات إلى داخل السائل.
و يعرف الشغل المبذول لزيادة مساحة سطح سائل ما بمقدار وحدة المساحات بمعامل التوتر السطحى لهذا السائل و يتضح من التعريف أن وحداته هى جول/ متر مربع .
بعض التجارب والمشاهدات التى توضح أن التوتر السطحى لسائل يعمل على انقاص السطح المعرض له:
1) تصرف الزئبق فوق الزجاج:
إذا صببنا كمية من الزئبق فوق سطح من الزجاج الأملس النظيف ثم ضغطنا على الزئبق بساق زجاجية مثلا ، نجد أن الزئبق ينقسم إلى قطرات صغيرة كروية الشكل. و من المعروف أن الكرة هى الشكل الهندسى لحجم معين الذى له أصغر مساحة سطح. أى أن التوتر السطحى يحاول إنقاص مساحة السطح المعرض للزئبق.
2) قطرات المطر و قطرات الماء بصفة عامة كالساقطة من صنبور مثلا تأخذ شكلا كرويا و هو الشكل الهندسى الذى له أصغر مساحة سطح لهذا الحجم.
3) تجربة الحلقة و الخيط
هذه التجربة توضح أن التوتر السطحى يعمل على إنقاص السطح المعرض للسائل بالإضافة إلى أنها توضح أن التوتر السطحى قوة سطحية أى مماسية لسطح السائل.
نحضر حلقة من سلك معدنى نصف قطره بضعة سنتيمترات و نربط بها خيط له عروة بحيث يكون طول الخيط و العروة أكبر من قطر الحلقة المعدنية. نغمس هذه المجموعة فى محلول صابون ثم نرفعها بحرص. نلاحظ تكون طبقة رقيقة من محلول الصابون داخل الحلقة و تأخذ عروة الخيط شكلا عشوائيا غير محدد كما فى الشكل. و الآن بواسطة دبوس جاف نعمل ثقبا فى غشاء الصابون الموجود داخل العروة فيزال الجزء من غشاء الصابون داخل العروة و تأخذ العروة شكلا دائريا و يشد الخيط المكون لها فى اتجاه الحلقة المعدنية و يتناقص الجزء المتبقى من غشاء الصابون.
و تفسير هذه المشاهدة هو أنه فى الحالة الأولى كان الخيط المكون للعروة متأثرا عند كل نقطة من نقاطه بقوى متزنة أى متساوية على الجانبين و محصلتها صفرا و لذلك اتخذ الخيط شكلا غير محدد. أما عند نزع غشاء الصابون الموجود داخل العروة فأصبحت القوى المؤثرة على الخيط هى تلك القوى السطحية المؤثرة على الخيط إلى الخارج وواضح أن هذه القوى تؤثر عند كل نقطة من نقاط الخيط عموديا عليه بحيث أخذ الخيط الشكل الدائرى حتى تكون القوى المؤثرة علي دائما متعامدة عليه و مماسية لسطح السائل و هذه القوى تعمل على إنقاص مساحة سطح غشاء الصابون.
معامل التوتر السطحى
هناك تعريفان لمعامل التوتر السطحى
التعريف الأول : يعرف معامل التوتر السطحى عل أنه الشغل المبذول لزيادة مساحة سطح السائل بمقدار وحدة المساحات و وحداته هى جول/ م2 .
التعريف الثانى : هو القوة السطحية المؤثرة عموديا على وحدة الأطوال من سطح السائل. و وحداته هى نيوتن/ متر
و يتضح أن
و سنذكر بعض التجارب البسيطة التى توضح هذه المفاهيم :
نحضر إطار من سلك على شكل حرف U ينزلق على ذراعيه أفقيا قطعة خفيفة من سلك وليكن وزنها w1 إذا غمسنا هذه المجموعة فى محلول صابون و رفعناها تتكون طبقة من محلول الصابون داخل الإطار و نلاحظ أن السلك الأفقى القابل للإنزلاق سيرتفع بسرعة إلى أعلى و ذلك بسبب قوة التوتر السطحى التى تؤثر عموديا على كل وحدة أطوال من السلك فتشده إلى أعلى. ولكى يبقى السلك مكانه نحتاج إلى تعليق أوزان خفيفة w2 فى السلك . أى أن القوة التى تساوى وزن السلك و الأوزان أى F = w1 + w2 هى التى ستجعل السلك المنزلق يثبت فى وضعه الأفقى مهما كانت مساحة طبقة غشاء الصابون المتكونة لأنها هى التى ستتزن مع قوة التوتر السطحى التى بدورها تساوى 2lg و ذلك لأن غشاء الصابون له سطحان لهذا ضربنا معامل التوتر السطحى فى ضعف طول السلك .
والجدير بالذكر هنا أن نعرف أن هذه الظاهرة تختلف عن حالة شد الغشاء المطاطى فالزيادة فى مساحة غشاء المطاط تنتج عن استطالة الغشاء و لكن الزيادة فى مساحة غشاء محلول الصابون تنشأ عن نقل بعض جزيئات السائل من باطنه إلى سطحه و الشغل المبذول هنا يؤدى إلى زيادة طاقة وضع الجزيئات عند السطح عن طاقة وضع مثيلاتها فى باطن السائل.
زاوية التماس
عندما يتلامس السائل مع سطح جسم آخر كأن يوضع السائل فى إناء نشاهد فى أجزاء السائل المجاورة للإناء الذى يحتويه بعض الظواهر التى تنتج عن قوى التجاذب بين جزيئات السائل مع بعضها و تسمى قوى التماسك cohesive forces و قوى التجاذب بين جزيئات السائل و جزيئات الإناء و التى تسمى قوى الإلتصاق adhesive forces فإذا وضعنا كمية من الماء فى إناء من الزجاج نجد أن سطح الماء عند التقائه مع جدار الإناء قد ارتفع قليلا عن مستوى بقية أجزاء السطح. و نفس الشىء يحدث إذا سكبنا قطرة من الماء على سطح لوح زجاجى نظيف نجد أن الماء يلتصق بسطح اللوح الزجاجى و يبلله. و يرجع السبب فى ذلك أن جذب الزجاج للماء أى قوى الإلتصاق بين الماء و الزجاج أكبر من قوى التجاذب بين جزيئات الماء.
والأمر مختلف فى حالة الزئبق مع الزجاج. فإذا وضعنا كمية من الزئبق فى إناء زجاجى صغير نجد سطح الزئبق عند نقطة التقائه مع جدار الإناء ينخفض عن بقية أجزاء السطح و يتحدب السطح الحر للزئبق. كذلك إذا سكبنا قطرة من الزئبق على سطح لوح زجاجى أملس نظيف نجد أن قطرة الزئبق تتكور أى أنه فى كلا الحالتين نجد أن جزيئات الزئبق تحاول أن تبتعد عن جزيئات الزجاج التى وجدت بجوارها و بصيغة أخرى فإن قوى التماسك بين جزيئات الزئبق بعضها البعض أكبر من قوى الإلتصاق بين الزئبق و الزجاج. و الآن إذا رسمنا المماس لسطح السائل عند نقطة تماسه مع سطح الصلب الملامس له أى سطح الإناء الذى يحتويه فإن الزاوية بين السطح الصلب الملامس للسائل حتى المماس لسطح السائل عند تلامسه مع سطح الصلب تسمى زاوية التماس أى أن :
زاوية التماس : هى الزاوية فى باطن السائل بين سطح الجسم الصلب و المماس لسطح السائل عند موضع تقابله معه .
و قد تكون زاوية التماس اكبر من 90 5 كما فى حالة الزئبق و الزجاج (137 درجة) و قد تكو أقل من 90 درجة كما فى حالة الماء و الزجاج غير النظيف أما إذا كان الزجاج نظيفا فإن زاويه التماس مع الماء تساوى الصفر و يقال أن الماء يبلل الزجاج تماما.
و يظهر ذلك جيدا إذا وضعنا كمية من الماء فى أنبوبة زجاجية أو مخبار فإن قوى الماسك بين جزيئات الماء تكون أقل من قوى الإلتصاق بينها و بين جزيئات الزجاج فيغلب تأثير قوى الإلتصاق و يؤدى هذا إلى إنتشار سطح الماء على سطح الزجاج و من ثم يرتفع سطح الماء عند تلامسه لجدار الأنبوبة و يتقعر السطح الحر له و تكون زاوية التماس حادة.
أما إذا وضع زئبق فى الأنبوبة فإن قوى التماسك بين جزيئات الزئبق تكون أكبر من قوى الإلتصاق بينها و بين جزيئات الزجاج و بالتالى تكون محصلتها نحو باطن الزئبق فينخفض سطحه عند التقائه مع جدار الأنبوبة و يتحدب السطح الحر له و تكون زاوية التماس منفرجة.
فرق الضغط داخل فقاعة غازية فى باطن سائل
نفرض فقاعة غازية نصف قطرها r قد تكونت فى باطن سائل يظل حجم هذه الفقاعة ثابتا طالما أن القوى التى تعمل على إنقاص حجمها تتزن مع القوى التى تزيد من حجمها. و للتعبير عن هذا الاتزان نفرض أننا شطرنا الفقاعة إلى نصفين مساحة مقطع كل منهما pr2 و محيط نصف الفقاعة عند موضع الانشطار هو 2pr
القوى F1 التى تعمل على إنقاص حجم الفقاعة هى القوى الناتجه عن الضغط الخارجى P1 و القوى الناتجة عن التوتر السطح على طول محيط نصف الفقاعة أى أن :
F1 = pr2 P1 + 2 pr g
أما القوى التى تعمل على زيادة حجم الفقاعة فهى القوى الناتجة عن الضغط الداخلى أى أن:
و لما كانت الفقاعة متزنة أى أن : F1 = F2 أى أن :
pr2 P1 + 2 pr g = pr2 P2
أى أن الفرق فى الضغط داخل الفقاعة عن خارجها P ~ يساوى :
P = P2 –P1 = 2 g/~r
و تنطبق هذه المعادلة على أى سطح منحنى لسائل مع مراعاة أن الضغط على جانب الوجه المقعر يكون أكبر من الضغط على جانب الوجه المحدب.
لذلك يجب مراعاة أن الفقاعات التى تتكون فى الهواء مثل فقاعة الصابون يكون لهه سطحان حران(السطح الخارجى و السطح الداخلى) معرضان للهواء بينما الفقاعة الغازية التى تتكون فى باطن السائل يكون لها سطح واحد. و بالتالى فإن الزيادة فى الضغط فى حالة فقاعة الصابون يساوى